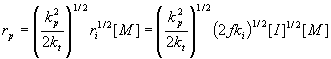|
유화 중합 / 일반적인 라디칼 중합의 속도론 - 2. 반응 속도식의 유도
|
|
2. 라디칼 중합반응 속도식의 유도
위의 식 1-식 7 처럼 라디칼 중합반응의 각 과정이 일어난다고 하면,
라디칼 중합속도, rp 는 식 8과 같이 된다.
rp = k'[R'][M] + k1p[R1][M] + k2p[R2][M] + ....... (8)
이 식을 다시 정리하면 식 9와 같이 쓸 수 있다.
rp = [M]k'[R'] + Σknp[Rn] (9)
k'[R']는 매우 작은 값이므로 무시하고, 라디칼의 반응성은 라디칼의 크기와 관련이 없다고 가정하면,
k1p = k2p = ...knp = kp 이 성립합니다.
이것들을 적용하여서 다시 식 9를 정리하면 식 10 이 얻어진다.
rp = kp[M]Σ[Rn]
= kp[M]![]() (10)
(10)
![]() 의 값 계산:
의 값 계산:
여기서 ![]() 은 성장 라디칼 전체의 농도이다.
은 성장 라디칼 전체의 농도이다.
|
|
= ri - rt = 0 |
(11) |
ri = k'[R'][M] ∝ 2ki[I] (12)
ri = 2fki[I] (13)
|
rt = 2kt |
|
2 |
(14) |
2fki[I]
= 2kt![]() 2 (15)
2 (15)
![]() ={fki[I]/ki}1/2
(16)
={fki[I]/ki}1/2
(16)
|
|
식 17의 의미:
라디칼 중합속도, rp 는 단량체 농도에 비례하고, 개시제 농도의 제곱근에 비례한다
|
1) 라디칼 중합 단계 |
||
|
|